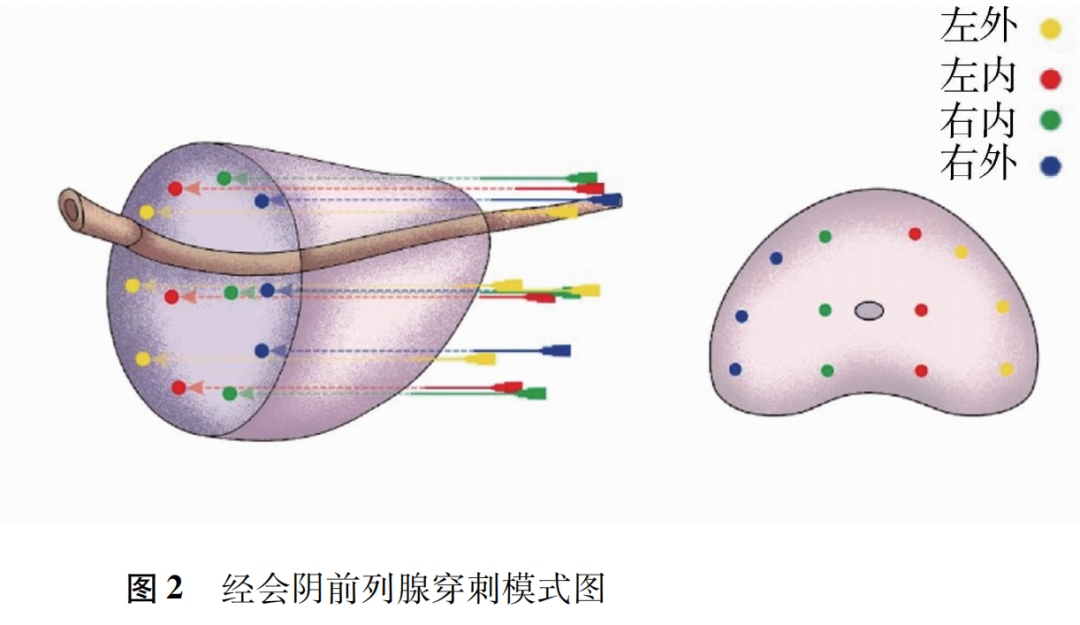
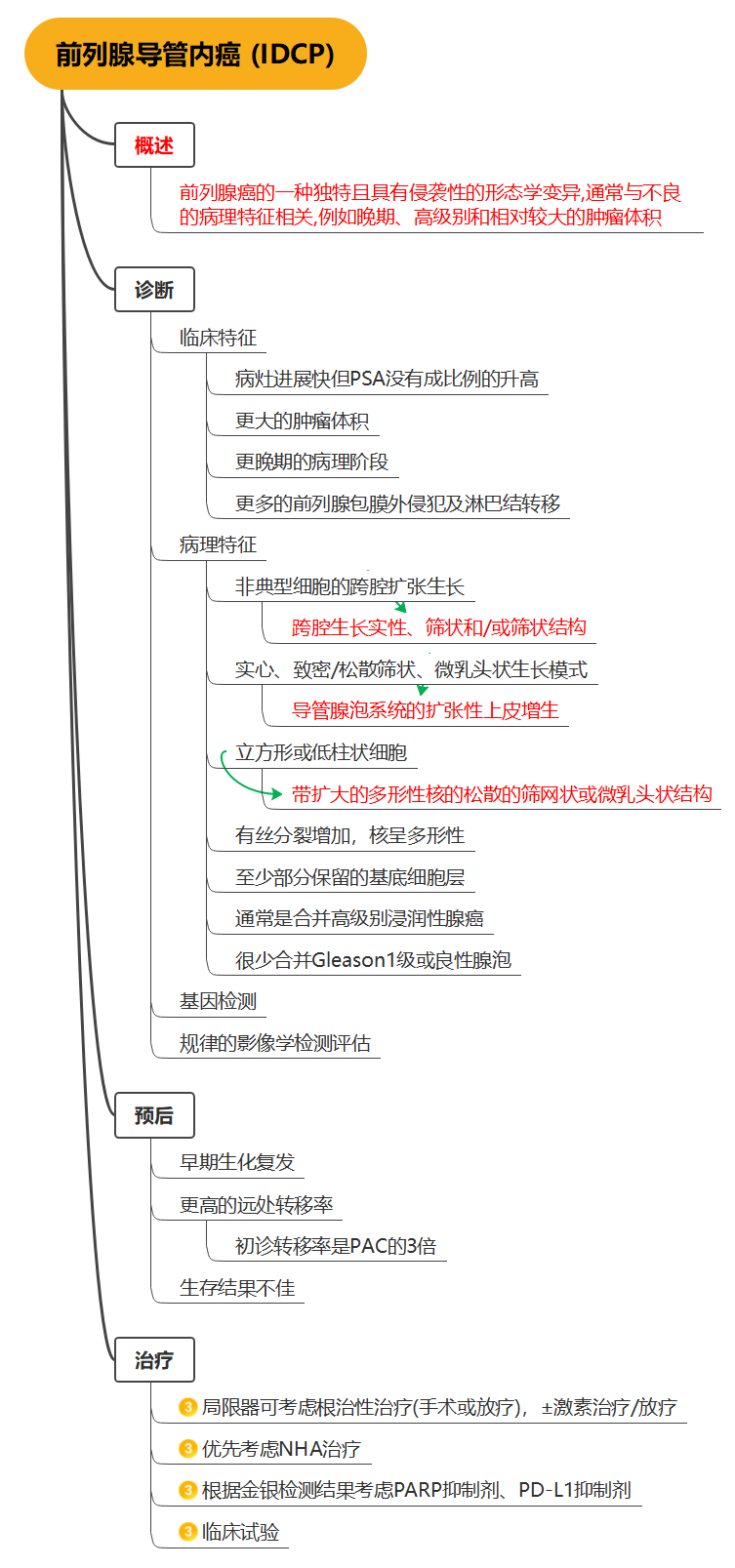
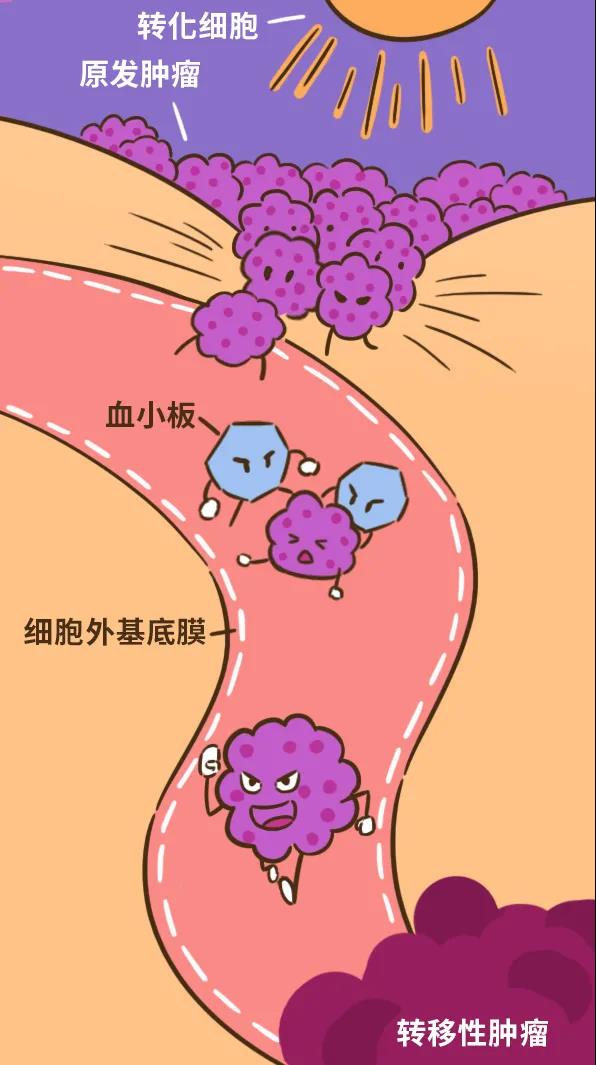
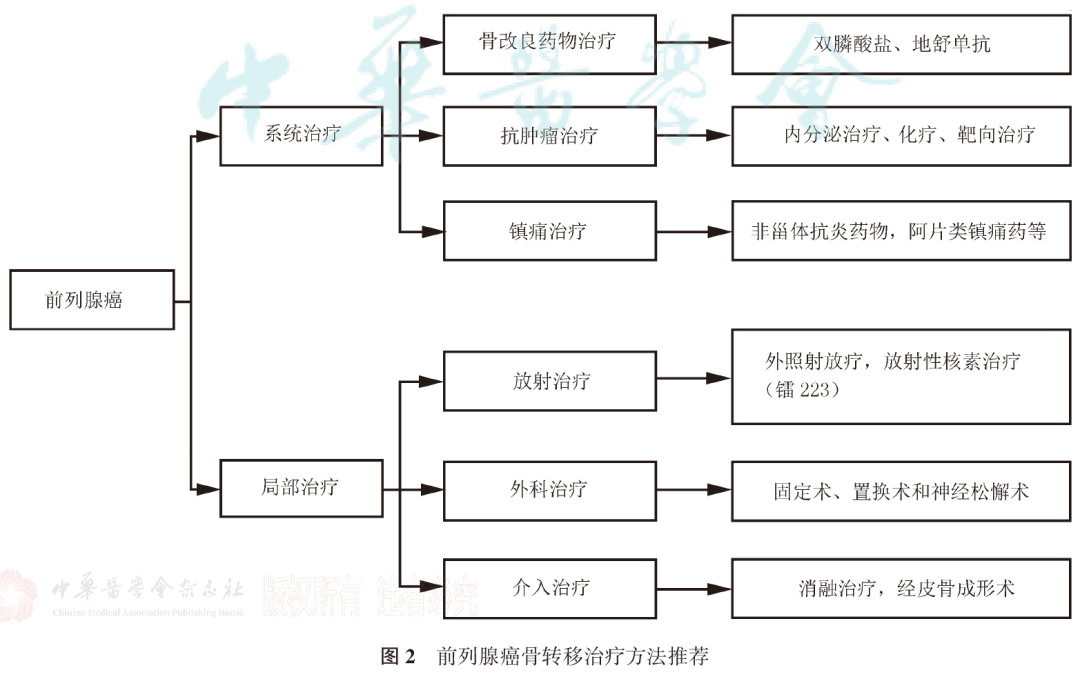
肿瘤分类系统的目标是将具有相似临床预后的患者归类在一起。这有助于与患者讨论预后情况,设计针对相对同质人群的临床试验,比较世界各地不同医院获得的临床和病理数据,并为这些患者人群的治疗制定建议。
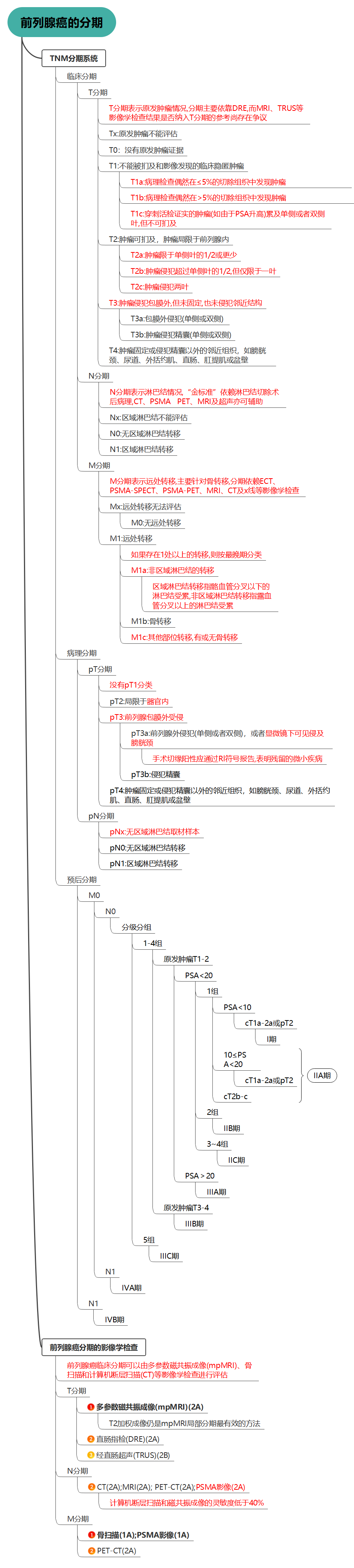
在指南中,使用了国际抗癌联盟(UICC)第8版(2017年)的TNM分期(表4.1)和EAU风险组分类。后一类是基于根治性前列腺切除术(RP)或外照射放疗(EBRT)后生化复发风险(BCR)相似的患者分组。
诊断方式的不同,如影像学(如MRI、前列腺特异性膜抗原[PSMA]和正电子发射断层扫描计算机断层扫描[PET/CT])和活检(如系统活检、靶向活检)可能导致风险分类系统的评价结果不同。
尽管2017年美国癌症联合委员会(AJCC)第8版分期指南明确指出,临床分期仅应基于直肠指检(DRE)的结果,但国际抗癌联盟(UICC)并未做出如此明确的说明。由于仅通过直肠指检评估的临床分期被纳入欧洲泌尿学协会(EAU)的D’Amico风险组分类中,因此临床T分期的判定应基于直肠指检的结果,而不是基于影像学结果。基于影像学得到的额外分期信息应单独报告列出。
因此,如果前列腺癌在直肠指检中无法触及,但双侧活检呈阳性,且MRI显示前列腺外侵犯(EPE),则应归类为cT1c,并单独列出MRI报告结果。

1.转移灶大小不超过0.2厘米时,可标记为pNmi。
2.当存在多个转移部位时,使用最晚期别的分期。其中,(p)M1c是最晚分期。
病理分期(pTNM)基于组织病理学评估,并与临床TNM分期大致平行一致,但临床T1和T2亚分期除外。病理分期中不存在pT1a/b/c,根治性前列腺切除术(RP)后组织病理学证实的局限于器官的前列腺癌属于病理分期pT2。目前的UICC分类不再区分pT2的亚分期。
值得注意的是,欧洲核医学协会(EANM)最近提出了一种分子影像TNM(‘miTNM’)分类方法,该方法考虑了PSMA PET/CT的检查结果。由于“Will Rogers现象”的存在,miT、miN和miM亚分期的预后可能优于相应的T、N和M分期。然而,这种预后差异的程度、实际意义和影响仍需进一步评估。国际抗癌联盟(UICC)和美国癌症联合委员会(AJCC)尚未认可这种重新分类方法。
在最初的Gleason评分系统中,根据肿瘤的组织学结构区分了5个Gleason等级(从1到5)。然而,在2005年和2014年国际泌尿病理协会(ISUP)共识会议上,Gleason等级1和2被取消。
2005年ISUP修改的前列腺癌活检Gleason评分(GS)包括最常见(主要)成分的Gleason等级;如果存在两种成分,则加上第二常见(次要)成分的等级。如果只有一种成分存在,则需要将其翻倍以得出GS。对于三种等级,活检GS包括最常见成分的等级和最高等级,不考虑其范围。
如果导管内癌(IDC)与浸润性前列腺癌混合存在,则应根据其基础组织学成分考虑是否将其纳入GS评估。
除了报告每个活检样本的癌症特征外,还可以提供基于阳性活检样本的总体(或全局)GS。全局GS考虑了所有前列腺活检样本中每个等级的累积。
2014年和2019年ISUP批准了一个限制前列腺癌等级数量的分级系统,范围从1到5(见表4.2)。
表4.2 国际泌尿病理学会2014分级系统

“临床显著性”这一术语被广泛用于区分可能对特定患者造成发病或死亡的前列腺癌(PCa)与那些很少导致此类后果的。
这种区分尤为重要,因为非显著性前列腺癌相当常见。如果不进行这种区分,这类癌症就存在过度治疗的风险,而治疗本身也可能给患者带来有害副作用。非显著性前列腺癌的过度治疗也被诟病是基于人群筛查和个体早期检测的主要缺点。
尽管病理因素常被用来界定非显著性前列腺癌,但显著性与非显著性的定义实际上是肿瘤因素与患者因素之间的平衡。除了预期寿命有限的情况外,高危前列腺癌几乎对所有男性来说都是显著的。而低风险前列腺癌则几乎对所有男性来说都是非显著的。
从病理学的角度来看,在大量关于仅为ISUP(国际泌尿病理学会)1级的前列腺根治切除术(RP)样本的研究中,发生前列腺包膜外侵犯(EPE)的概率极低(0.3%),生化复发(3.5%)也较为罕见,且未出现精囊(SV)侵犯或淋巴结转移(LN)的情况。
因此,在RP中,ISUP 1级本身可以被视为临床非显著性的。尽管ISUP 1级在组织学上具有癌症的特征,但在RP中,ISUP 1级本身并不会以临床恶性的方式发展。
值得注意的是,显示ISUP 1级病例无转移的研究都是在RP标本上进行的;在活检中,ISUP 1级仅与发生转移和疾病特异性死亡的风险较低有关,这可能是由于对更高级别成分的采样不足。
在一项针对cT1-T2 cN0 ISUP 1级前列腺癌患者进行的mpMRI靶向活检的回顾性研究中,72%的患者在随后的RP中ISUP级别达到或超过2级,9%的患者ISUP级别达到或超过3级,25%的患者为pT3a期,4%的患者为pT3b期。
最后,在过去十到十五年间ISUP的调整导致了GS分级的改变;例如,ISUP 2005的引入导致20%在此之前的GS 6级肿瘤被升级为GS 7级或更高,这在解读早期研究时需要考虑。
目前MRI靶向活检和模板活检的标准做法已经提高了诊断的准确性,但偏倚仍可能发生,因此可能会遗漏更高级别的癌症。在PSA密度高、病理活检肿瘤体积大和MRI可见病灶但活检仅显示ISUP 1级的情况下,尤其需要考虑这一点。
定义非显著性癌症的另一个复杂之处在于,ISUP 1级癌症可能会随着时间的推移进展为更高级别,从而在后续的活检中变得具有临床显著性。
因此,尽管ISUP 1级本身可以被描述为临床非显著性前列腺癌,但重要的是也要考虑其他因素,包括年龄、活检前的影像学检查和足够的活检针数。
当与低风险临床因素相结合时(参见表4.3),ISUP 1级代表低风险前列腺癌,推荐的管理方案是主动监测(AS)或观察等待(WW)(参见第6.2.1.1节和第6.2.1.2节)。
有人提出将ISUP 1级“肿瘤”重新命名为不含“癌症”标签的术语。目前,关于改变这种疾病分类的广泛共识尚未达成。相反,尽管它可能是非显著性癌症,但应适当观察。
流行病学和尸检数据表明,在男性的一生中,会有一部分ISUP 2级前列腺癌可能无法被检测到,因此可能存在过度治疗的情况。在目前的指南中,可以为选择的中危前列腺癌患者提供延迟治疗,但缺乏明确的证据来确立适当的选择标准。
最近的一些文献对临床显著性癌症的定义各不相同,通常使用ISUP 2级及以上,甚至ISUP 3级及以上这样的标准,这表明缺乏共识以及其定义的不断演变。有些论文甚至在单一研究中提供了多种定义。由于缺乏足够的数据将现代组织学分级与客观临床终点联系起来,因此,作者必须在其自己的研究中定义和说明他们认为的临床显著性前列腺癌(csPCa)是什么,包括疾病的确切诊断方法。
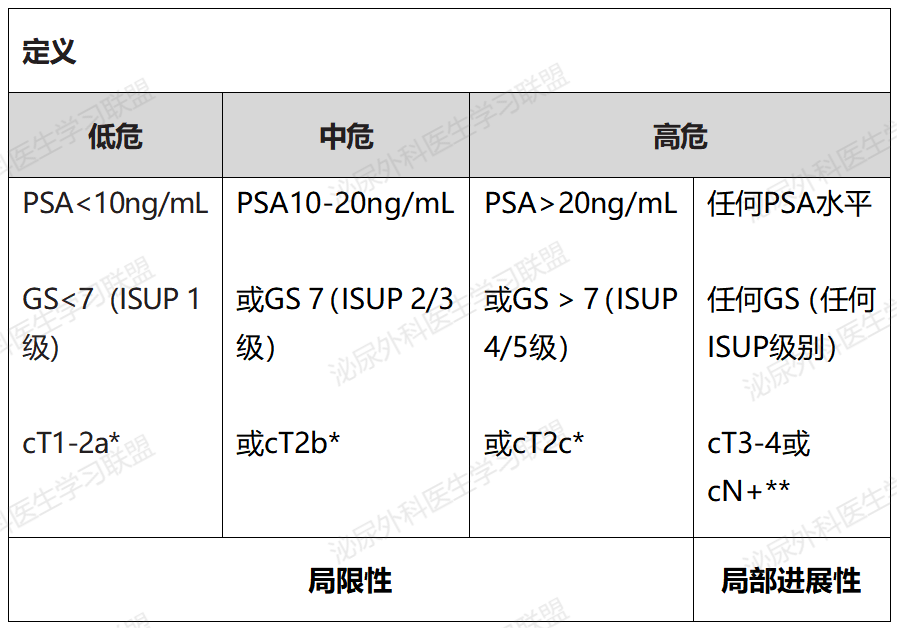
表4.3 欧洲泌尿外科协会(EAU)针对局限性及局部进展性前列腺癌生化复发的风险分组(基于系统活检)

GS = Gleason score; ISUP = International Society for Urological Pathology; PSA = prostate-specific antigen.
*基于直肠指诊
**基于CT/骨扫描
TNM分期是肿瘤解剖范围的示例表示,而病理分级则反映了肿瘤内在的侵袭性特征。欧洲泌尿协会(EAU)风险组分类基本上是基于D’Amico的前列腺癌分类系统,结合了来自系统活检的肿瘤范围、PSA和病理学的信息(表4.3)。
对临床上异质性的中危组患者进行更精确的分层,可以为他们的管理提供更好的框架。具体来说,NCCN指南将中危疾病细分为有利中危和不利中危,其中不利特征包括ISUP 3级,和/或≥50%的系统活检呈阳性,和/或至少两个中危因素。
2016年,剑桥研究小组提出了一个基于ISUP分级组、PSA和临床T分期的五级模型,该模型在前列腺癌特异性死亡率方面的判别性能显著优于目前的三级EAU风险组。该模型将EAU的中危和高危组分为临床上相关的亚组,并在多个队列研究中得到验证。